La recherche du diagnostic précoce vise à identifier et à développer des molécules traceuses (biomarqueurs) dans le sang ou dans le liquide céphalo-rachidien (LCR) permettant de dire qu’il y a une très forte présomption de développement de la maladie d’Alzheimer. Ces biomarqueurs existent mais restent encore réservés au domaine de la recherche car leur prédictivité reste insuffisante : le risque est d’annoncer à tort la maladie et donc la survenue future des signes, ou d’écarter à tort la survenue future des signes.
Où en est la recherche ?
Instaurer, dès l’apparition des premiers signes, un traitement médicamenteux visant à stopper ou réduire et à prévenir l’apparition des lésions cérébrales dans le cerveau permettrait d’éviter l’aggravation des signes et la survenue de complications. Malgré les avancées de la recherche, il n’en est rien aujourd’hui.
De manière globale, la stratégie de recherche médicale dans le domaine de la maladie d’Alzheimer s’articule autour de 4 axes et vise à apporter des réponses dans différents domaines, en particulier :
- un diagnostic de la maladie de plus en plus précoce (dès l’apparition des premiers signes),
- un diagnostic de la maladie à un stade dit « pré-symptomatique » (avant même l’apparition des premiers signes de la maladie),
- un traitement médicamenteux curatif (qui permet de guérir),
- un traitement médicamenteux symptomatique (qui permet de ralentir l’évolution des signes de la maladie).
La recherche du diagnostic précoce
Le diagnostic de la maladie avant même la survenue des premiers signes
À ce stade, la personne ne présente aucun signe de la maladie ; elle ne demande rien et ne se plaint de rien. Cependant, dans le sang et/ou le liquide céphalo-rachidien par exemple, des biomarqueurs sont déjà présents. Là encore, il est impératif que les biomarqueurs aient une très forte prédictivité.
Ces dosages, aidés d’étude du patrimoine génétique et de l’imagerie, relèvent strictement du domaine de la recherche (5 études en cours dans le monde). Les populations étudiées sont des formes familiales (génétique) où l’on est (quasiment) certain que les personnes porteuses des biomarqueurs et/ou de mutations génétiques vont développer la maladie dans les prochaines années, ou sont en train de développer la maladie.
Ce type de recherche fait l’objet de discussions d’ordre éthique et juridique. Peut-on intervenir et annoncer le diagnostic à une personne qui ne présente aucun signe (aucun déclin) et ne formule aucune demande ou plainte ? Peut-on perturber la vie d’une personne alors qu’il n’y a pas de certitude totale quant à la survenue future de la maladie ? Et qu’il n’existe pas encore de médicaments curatifs ou symptomatiques validés pour cette population ?
Un traitement médicamenteux curatif (qui permet de guérir)
Même si les mécanismes menant à la création de ces lésions sont de mieux en mieux identifiés et décodés, les causes de ces mécanismes restent inconnues à ce jour. C’est pourquoi, en l’état des connaissances actuelles, il n’existe pas de médicament permettant de guérir la maladie d’Alzheimer. Il est peu probable qu’un tel médicament soit disponible avant 2030.
Un espoir possible…

Un espoir possible avec l’annonce des résultats prometteurs du Lecanemab par les laboratoires Eisai et Biogen. Il permettrait de réduire de 27 % le déclin cognitif des patients traités sur une période de 18 mois. Même si cette efficacité doit être confirmée et les effets secondaires étudiés, les États-Unis, le Japon et l’Europe ont accordé une autorisation de mise sur le marché anticipée au début de l’année 2023.
Un traitement médicamenteux symptomatique (qui permet de ralentir l’évolution des signes de la maladie)
Habituellement, sur 100 médicaments testés, seuls 10, au bout d’un long processus d’évaluation, obtiennent l’autorisation d’être vendus (AMM : autorisation de mise sur le marché). Dans le cadre de la maladie d’Alzheimer ou d’une maladie apparentée, le taux d’échec est de 99,6 % au lieu de 90 %.
En France, quatre molécules sont en vente en pharmacie : donépézil, galantamine, rivastigmine et mémantine. Ces médicaments ne sont plus remboursés par l’assurance maladie depuis le 1er août 2018. Ce qui signifie qu’ils ne sont pas disponibles dans toutes les pharmacies et le prix de vente est variable d’une pharmacie à l’autre. La raison avancée par les pouvoirs publics : ils ont peu d’impact sur l’évolution de la maladie et ils sont responsables d’effets indésirables.
Cependant, en pratique clinique, il est noté, dans certains cas, une atténuation des troubles psycho-comportementaux, en particulier dans la démence à corps de Léwy.
Découvrir les phases d'un essai clinique
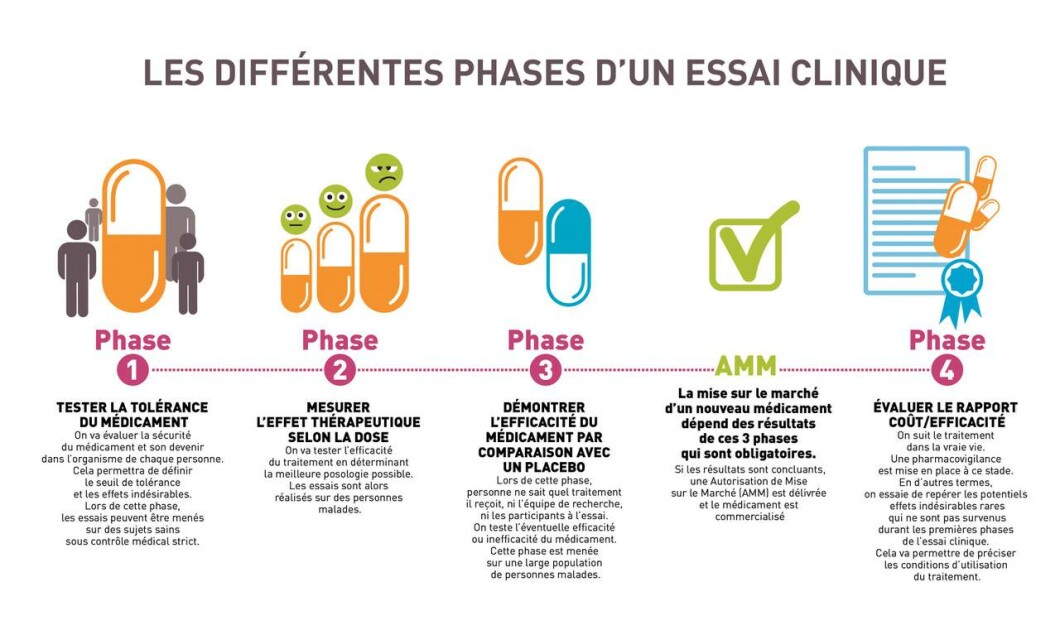
Pour que la recherche avance, des essais cliniques sont nécessaires.
De nombreuses années sont en effet nécessaires aux scientifiques pour mieux comprendre la maladie d’Alzheimer et tester de nombreuses hypothèses avant de passer chez l’être humain. Aucun traitement ne pourrait alors voir le jour et être proposé aux malades sans respectées toutes les phases.
Essais cliniques

Tous les essais cliniques portent sur des aspects différents de la maladie. Il peut s’agir d’essais cliniques de prévention ou d’essais cliniques de molécules. Aujourd’hui plus de 100 molécules sont en cours d’essais cliniques.
